Reforzamiento propio.
Angeheftet an
164
0
0
Keine Merkmale angegeben
|
|
Erstellt von Andrea Guadalupe
vor etwa 5 Jahre
|
|
Schließen
|
|
Erstellt von Andrea Guadalupe
vor etwa 5 Jahre
|
|

Benemérita Universidad Autónoma de Puebla.
"Preparatoria Regional Enrique Cabrera Barroso".
Asignatura Química I.
Profesora: Dolores Tapia Matías.
Alumna: Andrea Guadalupe Contreras.
Primer Semestre.
1°E Matutino.

INTRODUCCIÓN.
Estas fichas se realizaron con la intención de que como alumna pueda repasar previamente ciertos temas vistos en clase en la asignatura de química para reforzar mis conocimiento al igual de aclara dudas o comprobar información en ciertos criterios que me cueste trabajo entender y comprender para su realización y empleo de ellos en ejercicios o ponerlos en práctica en la vida cotidiana.
TIPOS DE ENLACE.
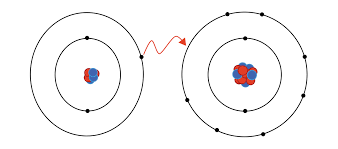
"Enlace iónico"
Se produce por transferencia de electrones entre un metal que es capaz de ceder electrones y un no metal capaz de captarlos. Es decir, entre átomos con electronegatividades diferentes. El átomo que pierde electrones se transforma en ion positivo o catión y el que acepta, en ion negativo o anión. El número de electrones perdidos o ganados determina el número de oxidación.
TIPOS DE ENLACE.
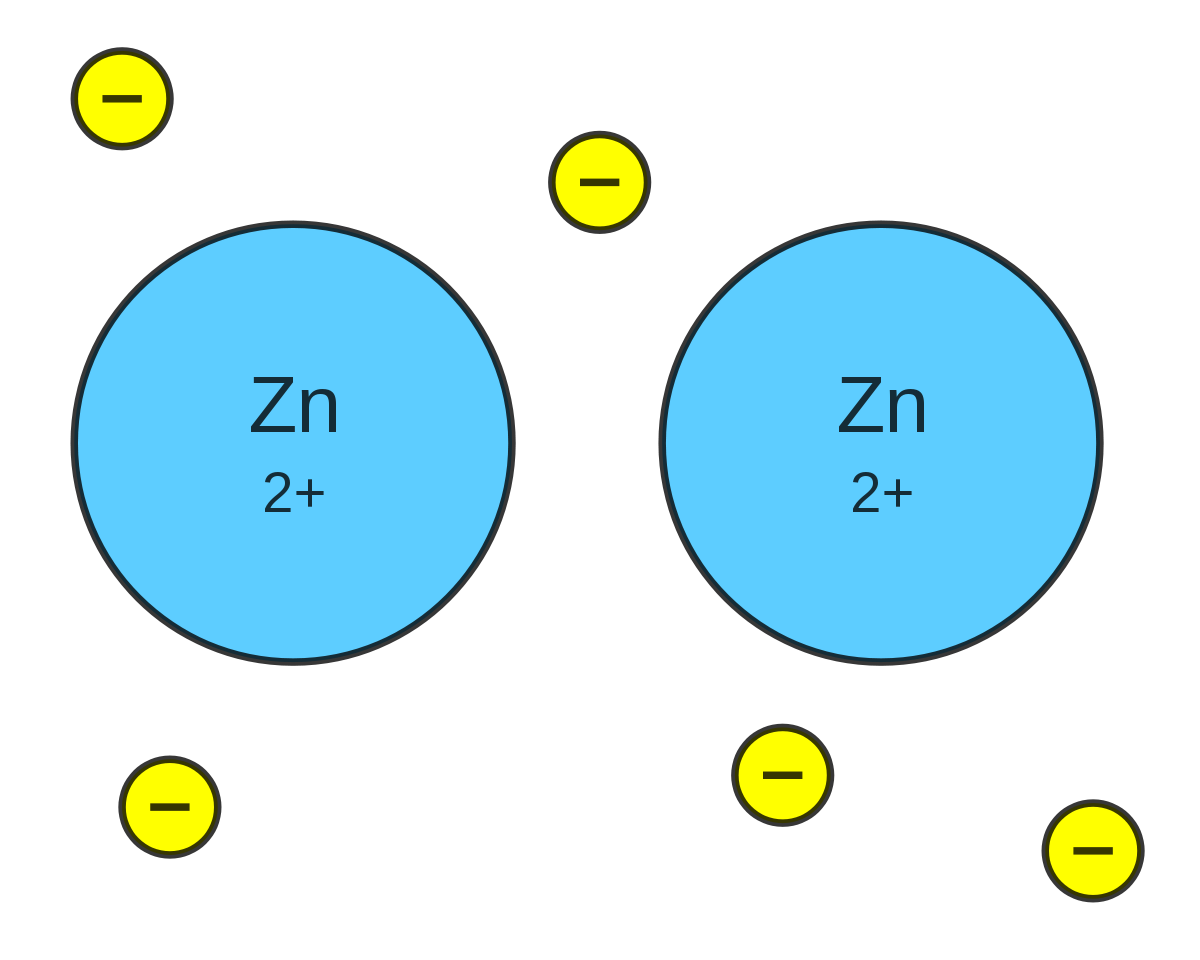
"Enlace metálico"
Es la unión de un elemento metal mas otro elemento metálico, son aleaciones metálicas y unos elementos metales son tales como el bronce, la plata o el oro, entre otros.
PROPIEDADES DE LOS ENLACES COVALENTES.
1. Son compuestos formados por moléculas perfectamente diferenciables.
2. Presentan un punto de ebullición y fusión relativamente bajos.
3. no funden a temperaturas superiores a 300 °C o no hierven a más de 600 °C.
"NOMENCLATURA"
La nomenclatura química puede considerarse como un idioma. Como tal, consta de palabras y debe obedecer a unas reglas de sintaxis. En la nomenclatura esta sintaxis incluye el uso de símbolos, tales como puntos, comas y guiones, el uso de números en determinados lugares por razones oportunas y el orden de citación de las palabras, silabas y símbolos.

"REGLAS DE OXIDACIÓN"
1. Para un elemento sin combinar el estado de oxidación es cero.
2. En un compuesto el elemento mas electronegativo lleva carga negativa y el menos lleva carga positiva.
3. Los metales alcalinos siempre trabajaran con +1 excepto el hidrógeno.
4. Los metales alcalinotérreos trabajaran con +2.
5. El oxigeno trabajara con -2 a excepción con los peróxidos.
6. El hidrógeno trabajara con +1 a excepción de los hidruros.
7. La suma de los estados de oxidación de un compuesto debe ser cero.
8. En un ion poliatómico, la suma de los estados de oxidación de los elementos que lo forman será igual a la carga de dicho ion.
"ECUACIÓN QUÍMICA"
Es la forma resumida de expresar, mediante símbolos y formulas, una reacción química. Es decir, es una representación taquigráfica, en ella se determina las sustancias reaccionantes, se predice los productos y se indica las proporciones de las sustancias que participan en dicha reacción.
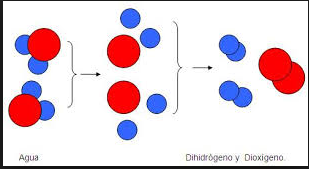
TIPO DE REACCIÓN QUÍMICA: REACCIÓN DE DESCOMPOSICIÓN.
Es una reacción que implica romper una sustancia en compuestos más simples y su fórmula general es: AB produce A+B.
TIPO DE REACCIÓN QUÍMICA: REACCIÓN DE DESPLAZAMIENTO DOBLE.
Es la reacción entre dos compuestos en los cuales se efectúa un intercambio de elementos. Típicamente los reactivos son dos compuestos iónicos que intercambian iones. Fórmula general: AB+CD produce AD+CB.
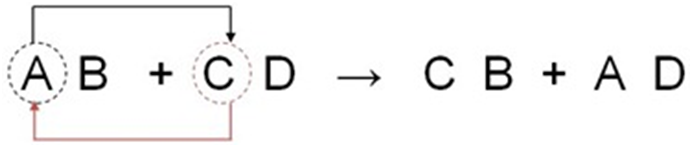
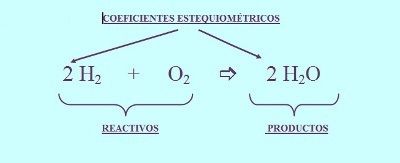
"BALANCEO DE ECUACIONES QUÍMICAS POR TANTEO"
Balancear por el método de tanteo consiste en colocar números grandes denominados coeficientes a la izquierda del compuesto o elemento del que se trate. De manera que el tanteo lograremos una equivalencia entre los reactivos y los productos.

CONCLUSIÓN
Espero que estas fichas haya sido de ayuda para retomar temas vistos en clase y aclara mis dudas sobre estos criterios para reforzar mi conocimiento acerca de estos temas.

 Verberge bekannte Karten
Verberge bekannte Karten