21147829
Modelos Atómicos.
Description
Flashcards by MARTHA PATRICIA PORTUGAL DUARTE, updated more than 1 year ago
More
Less
|
Created by MARTHA PATRICIA PORTUGAL DUARTE
over 4 years ago
|
|
Resource summary
| Question | Answer |
| Demócrito y Leucipo (460 a 630 A. C.) | Concibieron por primera vez la idea de que la materia puede dividirse en partículas cada vez más pequeñas; llamadas átomo (que significa, sin división). No plantearon ningún modelo. |
|
¿Quién propuso este modelo de átomo?
Image:
Dalton (binary/octet-stream)
|
John Dalton (1803); Modelo esférico. Retomó la idea de átomo, concibiéndola como una esfera sólida y diminuta, que conforma tanto a los elementos (átomos iguales), como a los compuestos (unión de átomos distintos). |
| 1864: Naturaleza de la luz y energía. | James C. Maxwell, explicó la naturaleza y características de la luz y de otras formas de energía similares (radio ondas, microondas, infrarrojo, luz ultravioleta, rayos X y rayos gamma), señalando que son formas de radiación electromagnética. |
| (1886): Protones. | Eugen Goldstein, descubrió los rayos canales, formados por partículas con carga eléctrica positiva a las que denominó protones. |
|
1895: Rayos X.
Image:
X (binary/octet-stream)
|
Wilhelm Roentgen descubrió un nuevo tipo de radiación electromagnética, similar a la luz en su naturaleza pero mucho más penetrante de alta frecuencia, llamados rayos X. |
| ¿Quién es el autor del modelo de pudín con pasas? | Joshep John Thomson, en 1897 encontró unos rayos que estaban conformados por “corpúsculos” de carga negativa a los que posteriormente George J. Stoney dio el nombre de electrones. |
|
Image:
Planck (binary/octet-stream)
|
Max Planck, (1900) mediante formulaciones matemáticas: aseguró que las “vibraciones” de los átomos eran las responsables de que se emitiera la radiación electromagnética y estas estaban “cuantizadas”, es decir, contenían una cantidad específica de energía |
| 1905: Albert Einstein y los fotones. | Al combinar sus observaciones con la ecuación de Planck, incorporó una nueva idea: la luz no sólo tiene propiedades de onda, también tiene propiedades de partícula, pero sin masa, y estas las llamó fotones o “paquetes de energía” |
| Modelo Nuclear (1911) | Ernest Rutherford, propuso un nuevo modelo atómico en el que la carga positiva estaba concentrada en un núcleo diminuto, los electrones giran alrededor, suponiendo que iría perdiendo energía para chocar contra el núcleo por fuerte atracción, pero eso no ocurrió, |
|
1913
Modelo del sistema solar.
Image:
Bohr (binary/octet-stream)
|
Niels Bohr: explicó que los electrones no son atraídos por el núcleo atómico porque giran a grandes velocidades, ocupando ciertos niveles de energía u órbitas estables, circulares, también llamados niveles de energía, en torno al núcleo. |
| 1916 Modelo de órbitas elípticas. | Arnold Sommerfeld: encontró la falla del modelo atómico de Bohr. Explicó que los electrones no sólo giran en trayectorias circulares alrededor del núcleo, también lo hacen en órbitas de forma elíptica con el número cuántico secundario o azimutal y el número cuántico magnético (m). |
| 1924 Comportamiento oscilatorio dual onda-partícula. | Louis de Broglie retomó las ideas de Einstein en relación a que la luz tiene tanto propiedades de onda como de partícula y estableció una ecuación matemática donde relaciona la masa, la velocidad, la constante de Planck y la longitud de onda asociada. |
| 1925 | Werner Heisenberg plantea el principio de incertidumbre en los orbitales que poseen los electrones. Apoyado en la mecánica cuántica estima que no se puede llegar a conocer con certeza la posición o el momento lineal que tiene un electrón. |
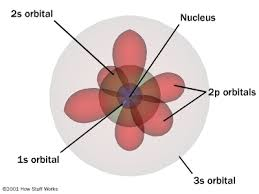
| 1926 Modelo probabilístico. | Erwin Schrödinger: afirma que el electrón se encuentran en zonas de probabilidad y no en órbitas bien definidas. Estableció una ecuación matemática compleja que permite obtener información sobre los electrones girando en “regiones de probabilidad” o zonas de densidad electrónica. |
| Para resolver la ecuación de onda, se emplean tres números cuánticos que sirven para definir los niveles de energía y los orbitales disponibles para cada electrón: número cuántico principal (n), secundario o azimutal (l) y magnético (m). | |
| 1932 : Neutrones | James Chadwick, descubre los neutrones, indicando que son partículas sin carga eléctrica, de masa y volumen muy similar a la de los protones. |
| bosón de Higgs https://www.youtube.com/watch?v=FdfD7ta9jdM neutrinos https://www.youtube.com/watch?v=F6J5FHSx5E0 |
Want to create your own Flashcards for free with GoConqr? Learn more.
Similar
Resumo para o exame nacional - Fernando Pessoa Ortónimo, Alberto Caeiro , Ricardo Reis e Álvaro Campos
miminoma
