Marcela Fernández 5to. Bach "A" clave: 12
Pinned to
28
0
0
No tags specified
|
|
Created by Marcela Fernandez
almost 7 years ago
|
|
Close
|
|
Created by Marcela Fernandez
almost 7 years ago
|
|

Átomos, Moléculas e Iones.
Marcela Fernández.
5to bach"A"
Clave: 12
Teoría atómica
John Dalton propuso 4 hipótesis para explicar la función de los átomos.
Primer Hipótesis: Los átomos de un elemento son diferentes para los demás átomos.
Segunda Hipótesis: (Ley de proporciones definidas)
Para formar algún compuesto, se requiere de la misma cantidad de átomos y la misma proporción de masa.
Tercera Hipótesis: (Ley de las proporciones múltiples)
Diferentes compuestos formados por los mismos elementos difieren en el número de átomos de cada clase.
Cuarta Hipótesis: (ley de la conservación de la masa)
La materia no se crea, ni se destruye.
Estructura del átomo
Los átomos se clasifican en tres: "electrones, protones y neutrones".
Electrones: Son partículas de carga negativa.
Protones: Son las partículas del núcleo con carga positiva.
Neutrones: Son Partículas neutras con una masa mayor que la de los protones.
Radiactividad
Son rayos provenientes del componente "uranio". Son altamente enérgicos y ni un imán los puede desviar.
Existen los rayos "alfa", con carga positiva y rayos "beta", con carga negativa.
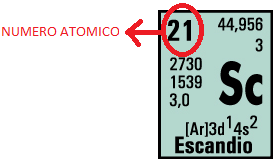
Número atómico (Z)
Número de protones en el núcleo de cada átomo de un elemento.
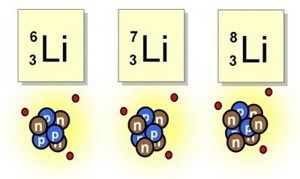
Isótopos
Mismo número atómico, diferente número de masa.
Períodos: Son las filas horizontales de la tabla periódica.
Grupos: Son las columnas verticales.

Moléculas
Agregación de dos átomos o más que se mantienen unidos por medio de fuerzas químicas.
Pueden ser diatómica: que son sólo dos átomos, o también poliatómica: que contienen más de 2 átomos.
Iones
1 átomo o un grupo de átomos que tienen una carga NETA positiva o negativa.
Anión: Ion con carga neta es negativa.
Catión: Ion con carga neta positiva.
Fórmulas químicas
Es la composición de las moléculas y los compuestos iónicos, que se representan por símbolos químicos.
Fórmula molecular
Cantidad exacta de átomos de cada elemento que está presente en la unidad más pequeña de una sustancia.
Fórmula estructural
Cuántos átomos están unidos entre sí en una molécula.
Fórmula empírica
Elementos que estén presentes y la relación mínima, en números enteros entre sus átomos.
La fórmula de compuesto iónico siempre va a ser la misma que la empírica.
Compuesto iónico
Se pueden dividir en dos:
Binarios: compuestos formados por sólo dos elementos.
Ternarios: compuestos formados por tres elementos.
Compuestos moleculares
Son compuestos binarios que comúnmente están formados por elementos no metálicos.
Nomenclatura de los ácidos
Sustancia que libera iones de hidrógeno, cuando se disuelve en agua.
Oxoácidos: ácidos que contienen hidrógeno, oxígeno y otro elemento.
Nomenclatura de bases
Sustancia que libera iones hidroxilo cuando está disuelta en agua.
Hidratos
Compuestos que tienen un número específico de moléculas de agua unidas a ellos.

 Hide known cards
Hide known cards