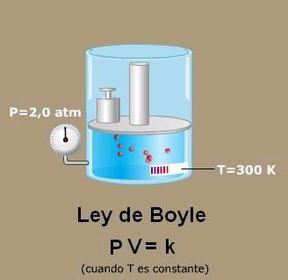
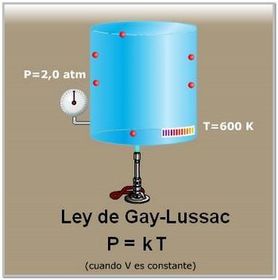
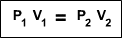En este archivo se habla de las propiedades de los gases e importancia de ellos en la cotidianidad, asi mismo las cosas buena y malas
Pinned to
235
3
0
No tags specified
|
|
Created by santiagotriana
almost 10 years ago
|
|
Close