PROCEDIMIEBNTOS PARA NALSISI DE SUSPENSION DE SOLIDOS DISUELTOS EN AGUA
Pinned to
236
0
0
No tags specified

|
Created by ARMANDO SILVA PACHECO
over 9 years ago
|
|
Close

|
Created by ARMANDO SILVA PACHECO
over 9 years ago
|
|

ANALISIS de AGUA: SOLIDOS EN SUSPENSION AGUA

Sólidos. Residuo total

Residuo fijo.

Sólidos sedimentables

Conductividad
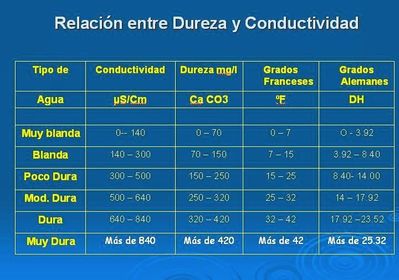
La conductividad específica, K, de un agua se define como la conductividad de una
columna de agua comprendida entre dos electrodos metálicos separados 1 cm.
Para la medida de la conductividad específica K, se mide la conductividad C de una
columna de agua entre dos electrodos de A cm2 separados 1 cm. Por definición:
C = K x (A/1)
Alcalinidad

La alcalinidad se determina por titulación de la muestra con una solución valorada de un
ácido fuerte como el HCl, mediante dos puntos sucesivos de equivalencia, indicados por
medio del cambio de color de dos indicadores ácido-base adecuados:
CO3 2– -HCO3 y HCO3 –
-H2CO3

Si las muestras de agua tienen un pH menor que 8.3 la titulación se lleva a cabo en una sola etapa.
Se agregan unas gotas de indicador de azul de bromofenol, apareciendo una
coloración azul y se procede a titular con solución de HCl hasta la aparición de un color verde con eso
se titula los HCO3–.
El color de la muestra, alta concentración de cloro y la formación de precipitados al titular
la muestra, interfieren, ya que pueden enmascarar el cambio de color del indicador.
El material necesario es:
Los reactivos son:
Agua destilada
Debe cumplir la especificación ASTM D 1193 tipo I, además, deberá estar libre de CO2 y
tener un pH a 25°C entre 6.2 y 7.2
Azul de bromofenol (0.04%)
Disolver 0.04 g de azul de bromofenol en 15 mL NaOH 0.01N y aforar a 100 mL con agua
destilada.
Solución de Na2C03 0.01 N
Na2CO3 secado a 110°C durante dos horas.
Disolver 0.530 g de Na2CO3 en agua destilada y aforar a 1000 mL
Calcular la normalidad:
Na2CO3 HCl
V1 x N1 = V2 x N2
V1xN1
N2= ---------
V2
Procedimiento

Cálculos
2V x N x 1000
meq/L de CO3 = ------------------------
mL de muestra
T son los mL de HCl gastado en las 2 titulaciones
V son los mL gastados en la primera titulación
N es la normalidad del HCl
Precisión
Este método tiene una precisión de ± 0.5 %

 Hide known cards
Hide known cards