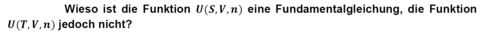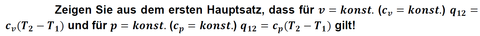Fragenteil
Pinned to
353
9
0
No tags specified
|
|
Created by Akram Ben Dhia
over 9 years ago
|
|
|
|
Copied by K G
over 9 years ago
|
|
|
|
Copied by strapp3.9
over 9 years ago
|
|
|
|
Copied by maxi-strobel
over 9 years ago
|
|
Close