Fichas de estudio de Nomenclatura
Pinned to
125
0
0
No tags specified
|
|
Created by Oscar Emmanuel Sierra Buechsel
10 months ago
|
|
Close
|
|
Created by Oscar Emmanuel Sierra Buechsel
10 months ago
|
|

NOMENCLATURA

IONES
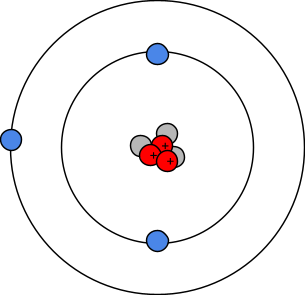
IONES MONOATÓMICOS
IONES POLIATÓMICOS
MOLÉCULAS

ESTADOS DE OXIDACIÓN
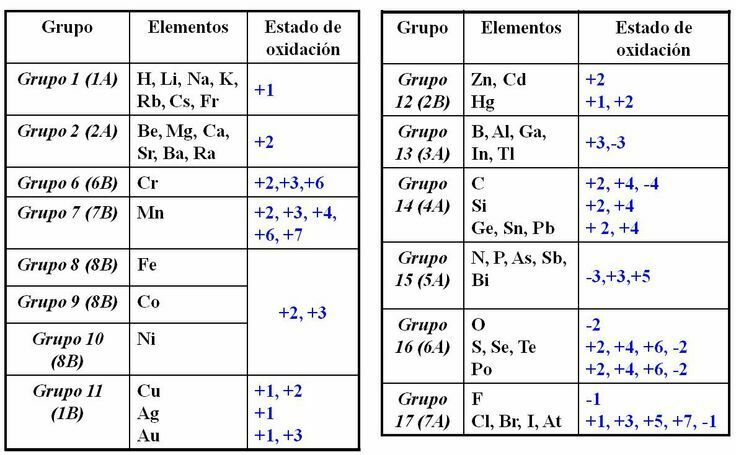
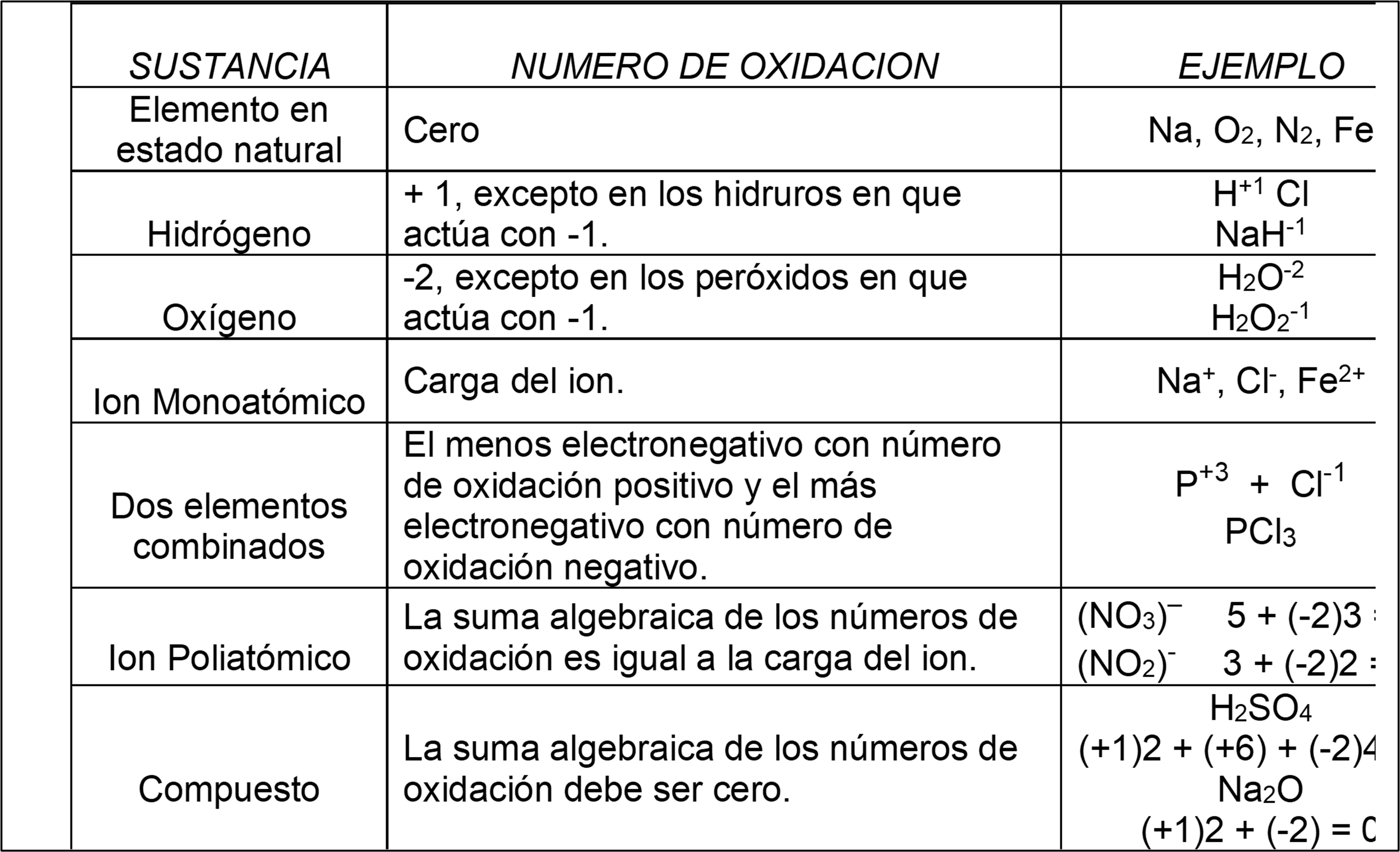
Relación de la Tabla Periódica y los Números de Oxidación
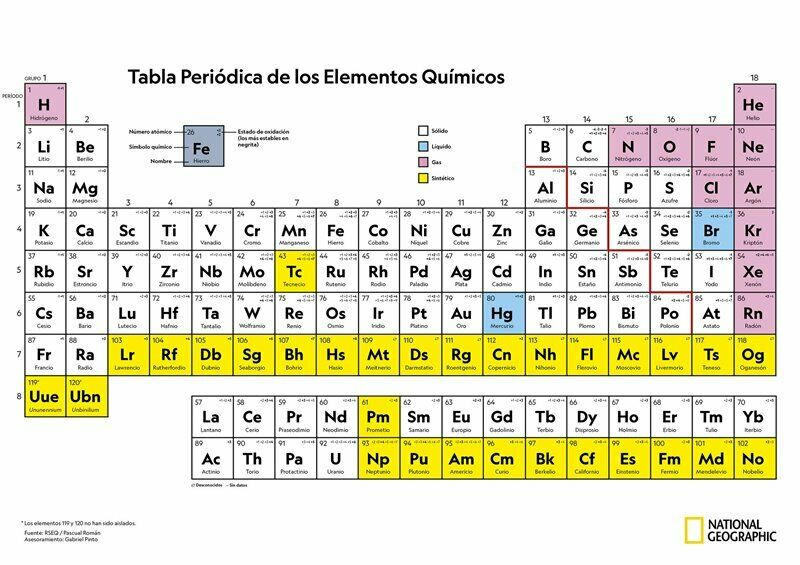
Nomenclatura
Sustancias Simples
Nomenclatura
Sustancias Compuestas
Nombre Genérico
Nombre Específico
Las sustancias compuestas se nombran bajo 3 sistemas
Sistema Clásico o Funcional
Sistema Estequiométrico
Sistema Stock
División de las Sustancias Compuestas
Compuestos Binarios
Binarios Oxígenados
ÓXIDOS Y ANHÍDRIDOS
ÓXIDOS: En el sistema clásico el nombre genérico es óxido y para el nombre específico se presentan dos casos:
Como en los óxidos el oxígeno siempre actúa con -2 se multiplica el subíndice del oxígeno por este valor y se calcula el número de oxidación del metal teniendo presente que la suma algebraica debe ser cero.
ANHÍDRIDOS:
Producto de la reacción del oxígeno con un elemento no metálico y con algunos metales de transición.
El flúor no forma anhídridos sino FLUORUROS; esto se debe a su gran electronegatividad y la fórmula sería OF2; fluoruro de oxígeno.
Si el elemento forma mas de dos anhídridos
En este caso el nombre específico se forma con el nombre del no metal con prefijos y sufijos que indican los números de oxidación positivos.
En los casos del carbono y silicio (Si) que tienen número de oxidación +4 y del Boro (B) con número de oxidación +3 se le da exclusivamente la terminación “ico”.
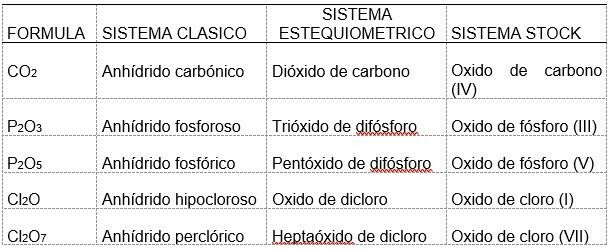
Característica: El oxígeno actúa con número de oxidación -1.
Nombre genérico: Peróxido
Nombre específico: El nombre del metal precedido de la palabra “de”.
Ej: H2O2 =Peróxido de hidrógeno (agua oxigenada)
Na2O2= Peróxido de sodio
BaO2= Peróxido de bario
Nombre genérico: Hidruro
Nombre específico: El del metal en genitivo o adjetivado, si solo forma un hidruro, si no el nombre del metal terminado en oso o en ico según actúe con su menor o mayor número de oxidación respectivamente.
Cuando el hidrógeno forma compuestos con metales de transición, son del tipo hidruros. En muchos casos, el hidrógeno más que combinarse se disuelve en el metal (OCLUSION) formando enlaces que no siguen la clasificación tradicional de iónico, covalente, etc.
Combinación del hidrógeno con los elementos del grupo IV A:
Estos forman con el hidrógeno, compuestos que tienen la propiedad de formar cadenas por uniones entre átomos de la misma naturaleza. Esta propiedad es mayor en el carbono y disminuye a medida que aumenta el peso atómico del elemento.
Combinación del hidrógeno con los elementos del grupo V A:
La facilidad de combinación de estos elementos con el hidrógeno disminuye al aumentar el peso atómico. Reciben nombres especiales, los cuales son aceptados por la nomenclatura actual.
Combinación del hidrógeno con los elementos de los grupos VI A y VII A
Los compuestos binarios del hidrógeno y los no metales de las familias VI A y VII A se nombran de la siguiente manera
Cuando estos compuestos se disuelven en agua, cambian sus propiedades. Las soluciones resultantes tienen sus propiedades ácidas el nombre de HIDRACIDOS.
Compuestos Binarios sin Oxígeno y sin hidrógeno.
Metal - no metal: sales haloideas
No metal - no metal
Metal - mercurio: amalgamas
Metal - metal: aleaciones

Metal Mercurio:
Nombre genérico: Amalgama
Nombre específico: El del otro metal
Ejemplo: Ag Hg: amalgama de plata
Algunas aleaciones tienen nombre especiales. Ejemplo:
Latón: Cu, Zn.
Bronce: Cu, Zn, Sn.
Peltre: Sn, Sb, Pb.
Acero: Fe, C.
Acero inoxidable: Fe, Cr, Ni.
Nombre genérico: Hidróxido
Nombre específico: El del metal en genitivo o adjetivado con los sufijos OSO o ICO para indicar su menor o mayor estado de oxidación.
Ej: Na OH= Hidróxido de sodio o sódico (sosa cáustica)
Cu OH= Hidróxido cuproso
Ácidos:
Se definen ácidos en relación a sus propiedades químicas, como: Un compuesto que en solución acuosa produce iones HIDRONIO (H3O)+.
Oxácidos:
Un oxácido es el producto de la reacción de un anhídrido u óxido ácido con el agua.
Cuando un anhídrido presenta distintos grados de hidratación, éstos se indican anteponiendo los prefijos META, Di o Bi y ORTO, al nombre específico, los grados de hidratación son: 1, 2 y 3 moléculas de agua.
Radicales o Iones Poliatómicos
OXIANIONES
Forman su nombre de la manera siguiente
Sales Ternarias:
Una sal es el producto de la sustitución total o parcial de los hidrógenos en un ácido o de los hidróxidos en una base. En las sales ternarias la sustitución es total.
Oxisales Neutras
Son combinaciones que resultan de la sustitución total de los hidrógenos de los oxácidos, por metales.
Sulfo-sales, Selen - sales y Teluri - sales:
Estas sales resultan de la sustitución de los oxígenos de las Oxisales por azufre, selenio o teluro respectivamente.
Sales dobles:
Estas sales resultan de la sustitución total o parcial de los hidrógenos de los hidrácidos que tienen dos hidrógenos sustituibles.
Cuando la sustitución es total da origen a las sales neutras, cuando solamente se sustituye un hidrógeno, entonces da lugar a la formación de sales ácidas.
Oxisales ácidas:
Una oxisal ácida es el producto de la sustitución parcial de los hidrógenos en un oxácido.
Cuando el oxácido tiene más de dos hidrógenos sustituibles, se pueden nombrar las oxisales, indicando las veces que se encuentra presente la función ácido, o suprimiendo la palabra ACIDO se nombra el número de átomos del metal.
Ej: Na2 HPO4 : Fosfato monoácido de sodio o bien fosfato disódico.
Se utiliza las mismas reglas dadas para las oxisales ácidas, cambiando la palabra ácido por la palabra BÁSICO, que indica la función base en la sal.
Ej: Ca OH NO3= nitrato básico de calcio.
Oxisales Dobles:
Son combinaciones que resultan de la sustitución total de los hidrógenos de los oxácidos que tienen dos o más hidrógenos sustituidos, por dos o más metales diferentes.
Hidratos:
Un hidrato es un compuesto que contiene moléculas de agua (usualmente llamada agua de cristalización) estructuralmente unidas.


 Hide known cards
Hide known cards