Grundlagen über Proteine, Enzyme und das Blut
Pinned to
680
3
0
No tags specified
|
|
Created by Mitra Shadloo
about 9 years ago
|
|
Close
|
|
Created by Mitra Shadloo
about 9 years ago
|
|

Proteine:
Bedeutung und Funktionen
Aminosäuren
Definition und Aufbau
Aminosäuren
Nomenklatur
Die Aminogruppe
Eigenschaften
Die Carboxylgruppe
Eigenschaften
pK-Wert
Ladung der AS in Bezug auf den pH-Wert
AS als Puffer
Mehrere pK-Werte
Titrationskurve Lysin
Isoelektrischer Punkt
Bei physiologischem pH-Wert...
Allgemeine Strukturformel einer L-Aminosäure
Proteinogene AS
Ungeladene (neutrale) Aminosäuren
Aliphatische AS
Eigenschaften
Wer gehört dazu?
Glycin
Alanin
Valin
Leucin
(Eigenschaften siehe Valin)
Isoleucin
(Eigenschaften siehe Valin)
Aromatische Aminosäuren
Eigenschaften
Wer gehört dazu?
Tyrosin
Tyrosin
weitere Eigenschaften
Phenylalanin
Tryptophan
Amide
Asparagin
Glutamin
Hydroxylierte Aminosäuren
Serin
Threonin
Schwefelhaltige Aminosäuren
Cystein
Eigenschaften
Cystein
Strukturformel
Methionin
Prolin
Eigenschaften
Prolin
Strukturformel
Geladene Aminosäuren
Basische AS
Eigenschaften
Wer gehört dazu?
Lysin
Eigenschaften
Lysin
Strukturformel
Arginin
Eigenschaften 1
Arginin
Eigenschaften 2
Arginin
Strukturformel
Histidin
Eigenschaften
Histidin
Eigenschaften 2
Histidin
Strukturformel
Saure Aminosäuren
Wer gehört dazu?
Eigenschaften
Glutamat
Strukturformel
Aspartat
Strukturformel
Wie entstehen nicht essenzielle AS?
Essenzielle AS
Unbedingt essenziell
bedingt essenziell
bei Fehlen von Phenylalanin bzw. Methionin
bei weitgehendem oder völligem Fehlen in der Nahrung und bei Säuglingen
Peptidbindungen
Wo werden sie gebildet?
Was passiert bei der Reaktion/welche Gruppen reagieren?
Peptidbindung
Edukte
Peptidbindung
Produkte
Partielle Doppelbindung
Wie sieht die Peptidbindung jetzt aus?
(Bild)
Was für eine Konsequenz hat dieser partielle Doppelbindungscharakter?
Was für eine Rolle spielen Wasserstoffbrücken?
Primärstruktur
Sekundärstruktur
Rolle der AS-Reste bei Ausbildung der Sekundärstruktur
Sekundärstrukturelemente.
α-Helix
WSB und Reste bei einer α-Helix
α-Helix
Ausnahme Prolin
β-Faltblatt
β-Faltblatt
Struktur Bild
Schleifen
Tertiärstruktur
Welche Welchselwirkungen kann es geben?
Bsp: Tertiärstruktur eines Hämboglobins
Hydrophobe Wechselwirkungen
Rolle hydrophober Wechselwirkungen
Disulfidbrücke und ionische Wechselwirkungen
Van-der-Waals-Kräfte
Wie werden sie hervorgerufen?
Quartärstruktur
Quartärstruktur Hämoglobin
Co- und Posttranslationale Modifikationen
Definition
Posttranslational
Proteolytische Prozessierung und limitierte Proteolyse:
Methionin
Posttranslational
Proteolytische Prozessierung und limitierte Proteolyse:
Peptidhormone
Posttranslational
Proteolytische Prozessierung und limitierte Proteolyse:
Inaktive Enzyme (Zymogene)
Posttranslational
Hydroxylierung:
Posttranslational
Carboxylierung:
Vit. K Antagonisten
Phosphorylierung:
Glykosylierung
Abbau von Proteinen
Hydrolyse der Proteine durch Proteasen
Welche Pankreas-Proteasen gibt es?
A
Welche Pankreas-Proteasen gibt es?
B
Was sind die Hydrolyseprodukte der Serin- & Carboxypeptidasen?
Bild
Resorption der Hydrolyseprodukte
Freie AS
Bild
Resorption der Hydrolyseprodukte
Di- & Tripeptide
Die Struktur des Hämoglobins
Bindung von O2
Bild
Was ist eine Hämgruppe?
Wie werden die Hämgruppen im Hämoglobin gebunden?
Was bildet den Globin-Anteil des Moleküls?
Kohlenmonoxid (CO)
Symptome & Therapie
Kohlenmonoxid-Vergiftung
Struktur der Sauerstoffbindestelle
Bild
Auswirkungen der O2-Bindung auf die Ultrastruktur des Hämoglobins
T-Zustand
Was passiert, wenn ein O2 bindet?
Was für Folgen hat die Konformationsänderung?
Wie wird die Funktion des Hämoglobins dadurch beeinflusst?
Hämoglobin im O2-freien Zustand
Hämoglobin im O2-gebundenen Zustand
Was ist das besondere an der Wirkung der Konformationsänderung?
Wovon hängt die Menge an O2 ab, die Hämoglobin in der Lunge aufnimmt?
Merke
In den peripheren Geweben
die O2-Bindungskurve des Hämoglobins...
Im Bereich der hohen PO2-Werte...
Im Bereich der niedrigen PO2-Werte...
Bei niedrigen PO2-
Werten...
O2-Bindungskurve des Hämoglobins
Bild
Eine wesentliche Voraussetzung für den sigmoiden Verlauf der O2-Bindungskurve...
Die Bindung des ersten O2-Moleküls an eine der UE des Hämoglobins verändert...
Die Kooperativität der Hämoglobin-Untereinheiten ist der Grund dafür,
Die verschiedenen Hämoglobine des Menschen
Das HbF des Fetus...
Myoglobin
Anders als die Hämoglobine liegt Myoglobin aber stets...
Myoglobin kann nicht nur O2 binden, sondern...
Schutz des Hämoglobins vor
Oxidation
Methämoglobin entsteht...
Das Superoxidanion, O2– , ist....
Superoxidradikal
Wenn zwei Superoxidradikale aufeinander treffen,
Wasserstoffperoxid
H2O2 ist ein...
Ausgehend
von Superoxidradikalen kann neben H2O2 auch...
Hydroxylradikal
Schutzmechanismen
Bild
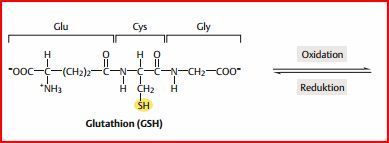
Glutathion
Glutathion wird von...
Bild
Bildung von Heinz-Körpern
Wichtige Antioxidanzien sind neben dem Glutathion....
Zudem ist die Kooperation der Enzyme auch in allen anderen Zellen des Körpers durch...
Superoxid-Dismutase
Katalase
Transport von CO2
Bicarbonat entsteht in einer Reaktion...
Die Reaktion verläuft normalerweise nur sehr langsam. Erythrozyten enthalten aber
ein Enzym:
Bicarbonat liegt im Blut in einer Konzentration von ca. 24 mmol/l vor und leistet...
Der zweitwichtigste Faktor für die Aufrechterhaltung des pH-Wertes ist das...
Transport gebunden an Hämoglobin
Die entstandene NHCOO–-Gruppe wird als...
Dieses hat eine bemerkenswerte Konsequenz:
Proteinfaltung
Was für eine Funktion hat sie?
Was ist durch die Gene festgelegt?
Was durch die AS-Sequenz?
Aus den bindenden Kräften...
Die Faltung erfolgt...
Dabei kann es passieren...
Folgen von Aggregatbildungen:
Wie kann eine Fehlfaltung verhindert werden?
Das Hauptproblem dabei
sind...
Dies können auch hydrophobe Bereiche...
Molekulare Chaperone sind...
Dies ist sinnvoll, da...
Was passiert, wenn die Faltung misslingt?
Nach dem Austritt einer hydrophoben Aminosäure aus dem Ribosom...
Funktion von Hsp70
Proteine mit einem komplizierten Faltungsweg müssen...
Die Tonne kann jetzt...
Molekulare Chaperone
des Hsp70-Typs unterstützen ...
Eine weitere wichtige Funktion von Hsp70 liegt...
Was können Hsp60 noch?
Funktion von Hsp60 bzw. Hsp10
Funktion von Hsp60 bzw. Hsp10
Was passiert im Inneren?

 Hide known cards
Hide known cards