Close

HISTORIA DEL MODELO ATOMICO

JOHN DALTON 1803
Descubrimientos: Durante el s.XVIII y principios del XIX algunos científicos habían investigado distintos aspectos de las reacciones químicas, obteniendo las llamadas leyes clásicas de la Química.
Modelo Atomico:
La imagen del átomo expuesta por Dalton en su teoría atómica, para explicar estas leyes, es la de minúsculas partículas esféricas, indivisibles e inmutables,iguales entre sí en cada elemento químico.

ERNEST RUTHERFORD 1911
Descubrimientos: Demostró que los átomos no eran macizos, como se creía, sino que están vacíos en su mayor parte y en su centro hay un diminuto núcleo.
Modelo Atomico: Dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente.
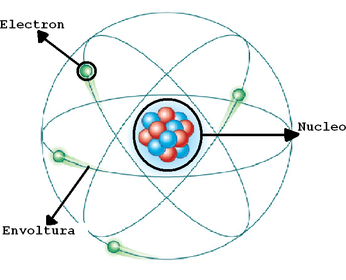
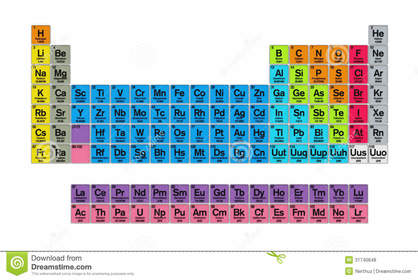
TABLA PERIODICA DE LOS ELEMENTOS
1829
Johann Wolfgang Dobereiner (1780-1849) descubrió que los elementos con propiedades semejantes pueden estudiarse agrupándolos en ternas o triadas, en las que el elemento central tiene una
masa atómica
aproximadamente igual a la media arimética de las masas atómicas de los otros dos.
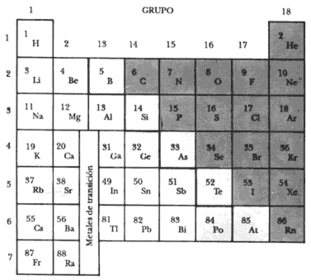
1869
El químico ruso
Dimitri Ivanovich Mendeleiev
(1834-1907),dispuso los elementos conocidos (63) en líneas por orden creciente de la masa atómica, de manera que los que tenían igual similaridad química
(valencia)
se hallaban ubicados en una misma hilera vertical. Estos elementos mostraban un gran parecido en sus propiedades. Esta organización la denominó Mendeléiev ley Periódica de los Elementos. Enésta, hubo las casillas suficientes para los nuevos elementos a descubrir en el futuro.

 Hide known cards
Hide known cards