Habla de la historia del modelo atomico y tabla periodica
Pinned to
840
0
0
No tags specified
|
|
Created by Gabriel Reyes
about 8 years ago
|
|
Close
|
|
Created by Gabriel Reyes
about 8 years ago
|
|

"Historia del Modelo Atómico y Tabla Periódica"
Primer Modelo Atómico: Modelo Atómico De Demócrito de Abdera
Este fue el primer modelo atómico, inventado por el filósofo griego Demócrito de Abdera que vivió entre los años 460 al 370 a.c (antes de Cristo).

Modelo Atómico De Dalton
modelo atomico de dalton
John Dalton fue un químico y matemático británico (entre otras muchas cosas) que vivió durante los años 1766 y 1844, de donde procede la palabra “Daltonismo”.
Seguro que sabrás que las personas daltónicas son aquellas que les es muy difícil distinguir los colores por un defecto genético. Esto te lo contamos como curiosidad ya que fue Dalton quien escribió sobre esto porque él mismo lo padecía. Aparte, fue el primero en desarrollar un modelo atómico con bases científicas.
Basándose en la idea de Demócrito, Dalton concluyó que el átomo era algo parecido a una esfera pequeñísima, también indivisible e inmutable.
Dalton hizo los siguientes “postulados” (afirmaciones o supuestos):
Modelo Atómico De Thomson
Joseph John Thomson fue un científico británico que vivió entre los años 1856 y 1940 que descubrió el electrón y los isótopos. Ganó el Premio Nobel de Física en 1906 y su teoría sobre el átomo decía que los átomos estaban compuestos por electrones de carga negativa en un átomo positivo, es decir, como si tuviéramos una bola cargada positivamente rellena de electrones (carga negativa), también conocido como Modelo del Pudin De Pasas porque parece un bizcocho relleno de pasas.

Modelo Atómico Cúbico De Lewis
Gilbert Newton Lewis fue un físico y químico estadounidense que vivió entre los años 1875 y 1946 que realizó numerosos trabajos científicos de los cuáles se destacan la “Estructura De Lewis” también conocida como el “Diagrama De Punto”. El modelo atómico de Lewis está basado en un cubo, donde decía que los electrones de un átomo se colocaban de forma cúbica, es decir, los electrones de un átomo estaban colocados en los vértices de un cubo.
Gracias a ésta teoría se conoció el concepto de “valencia de un electrón” es decir, esos electrones en el último nivel de energía de un elemento que pueden reaccionar o enlazarse con otro elemento.

Modelo Atómico De Rutherford
Ernest Rutherford fue un químico y físico neozelandés que vivió entre los años 1871 y 1937 que dedicó gran parte de su vida a estudiar las partículas radioactivas (partículas alfa, beta y gamma) y fue el primero de todos en definir un modelo atómico en el que pudo demostrar que un átomo está compuesto de un núcleo y una corteza. Ganó el Premio Nobel De La Química en 1908.

Modelo Atómico De Bohr
Este modelo también se llama de Bohr-Rutherford. Niels Henrik David Bohr fue un físico danés que vivió entre los años 1885 y 1962 que se basó en las teorías de Rutherford para explicar su modelo atómico.
En el modelo de Bohr se introdujo ya la teoría de la mecánica cuántica que pudo explicar cómo giraban los electrones alrededor del núcleo del átomo. Los electrones al girar entorno al núcleo definían unas órbitas circulares estables que Bohr explicó como que los electrones se pasaban de unas órbitas a otras para ganar o perder energía.

Modelo Atómico De Sommerfeld
Arnold Johannes Wilhelm Sommerfeld fue un físico alemán que vivió entre los años 1868 y 1951. La aportación más importante de este físico alemán fue cambiar el concepto de las órbitas circulares que definían los electrones en el modelo atómico de Bohr por órbitas elípticas.
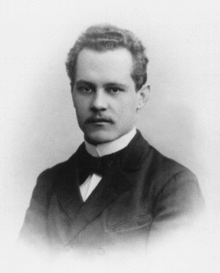
Modelo Atómico De Schrödinger
Erwin Rudolf Josef Alexander Schrödinger fue un físico austriaco que vivió entre los años 1887 y 1961 cuyo modelo cuántico y no relativista explica que los electrones no están en órbitas determinadas.
Describió la evolución del electrón alrededor del núcleo mediante ecuaciones matemáticas, pero no su posición.
Decía que su posición no se podía determinar con exactitud. Schrödinger propuso entonces una ecuación de onda que ayuda a predecir las regiones donde se encuentra el electrón, que se conoce como “ecuación de Schrödinger”.

Tabla Periodica

Döbereiner

Chancourtois y Newlands

Meyer

Mendeleïev


Citas

 Hide known cards
Hide known cards