Close

ESTRUCTURA DE
LEWIS

ENLACES INTERATÓMICOS
Enlace químico es la fuerza de atracción que mantienen unidos entre si a dos átomos o iones para formar moléculas o cristales.
2. Enlace covanlente: se genera cuando se unen dos átomos de no metales. Se define como "el enlace en el que los dos electrones de enlace son compartidos por dos átomos y los compuestos covalentes son aquellos que únicamente contiene enlaces covalentes" Formado por la unión de un no metal y un no metal
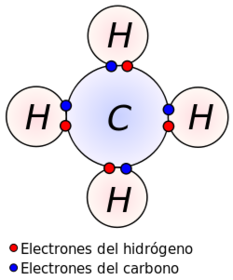
REGLA DEL OCTETO

NOMENCLATURA QUÍMICA ORGANICA

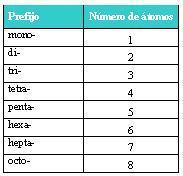
El nombre sistemático está formado por un prefijo, que indica el número de átomos de
carbono que contiene la molécula, y un sufijo, que indica la clase de compuesto
orgánico de que se trata.

NOMENCLATURA QUÍMICA INORGANICA
Para los compuestos inorgánicos bastan con las siguientes dos formulas para proporcionar las información necesaria de las moléculas o las redes cristalinas:
1. La formula química tiene como propósito expresar mediante símbolos y números la composición de las moléculas y los compuestos iónicos.
2. La formula empírica indica la relación mínima entre los átomos de cada elemento que conforma una sustancia.
ESTADO DE OXIDACIÓN
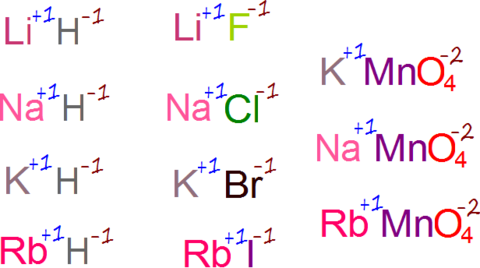
FUNCIONES QUÍMICAS

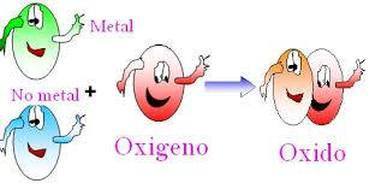
1. Función óxido: se caracteriza por tener el elemento oxigeno en la estructura molecular de las sustancias. Existen los óxidos metálicos que son la unión de átomos de oxigeno con un metal y los óxidos no metálicos conocidos también como anhídridos, formados por la unión de átomos de oxigeno y un no metal.
3. Función ácido: Se distingue por la presencia del ion hidronio (H)+1 en la molécula covalente. Se divide en hidrácidos que son la unión del ion hidronio con átomos de un no metal y oxiácidos que se presentan en su molécula covalente la presencia del ion hidroneo, átomos de no metal y átomos de oxigeno.

5. La función hidruro: Se define como la unión del átomo hidrógeno con otro átomo de menor electronegatividad, normalmente un metal. El numero de oxidación del átomo hidrógeno es H1-.

La fórmula molecular expresa el número real de átomos que forman una molécula a diferencia de la fórmula química que es la representación convencional de los elementos que forman una molécula o compuesto químico.

Compuestos químicos orgánicos
e inorgánicos.

Compuestos inorgánicos: Sus moléculas pueden contener átomos de cualquier elemento, incluso carbono bajo la forma de CO, CO2, carbonatos y bicarbonatos.
Se conocen aproximadamente unos 500000 compuestos.
Son, en general, "termo estables" es decir: resisten la acción del calor, y solo se descomponen a temperaturas superiores a los 700ºC.
Tienen puntos de ebullición y de fusión elevados.
Muchos son solubles en H2O y en disolventes polares.
Fundidos o en solución son buenos conductores de la corriente eléctrica: son "electrólitos".
Las reacciones que originan son generalmente instantáneas, mediante reacciones sencillas e iónicas.
HIDRÁCIDOS

OXIÁCIDOS

SALES BINARIAS

Oxisales

En la IUPAC existen 3 tipos de nomenclaturas para nombrar compuestos químicos en este caso inorgánicos.

Nomenclatura sistemática
Nomenclatura Tradicional


 Hide known cards
Hide known cards