guias de estudio sobre enlaces quimicos
Pinned to
3629
68
2
No tags specified
|
|
Created by Dayanna
over 10 years ago
|
|
Close
|
|
Created by Dayanna
over 10 years ago
|
|

¿Que es un enlace químico?
¿Quien determina el tipo de enlace químico que unirá la molécula ?


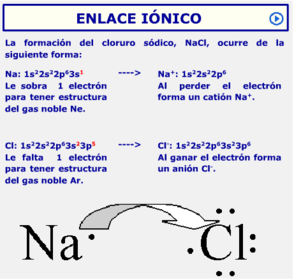
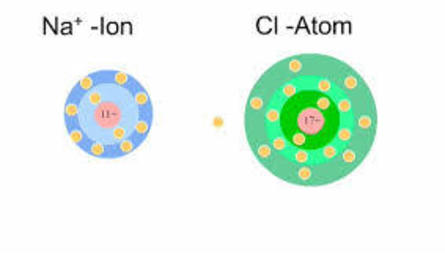
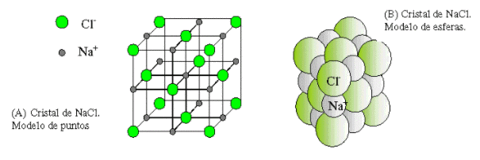
El enlace iónico se da entre iones de distinto signo, ya que las cargas de distinto signo se atraen.
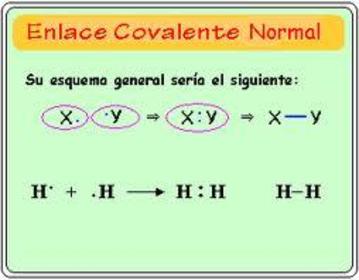
Atendiendo al número de pares de electrones compartidos:
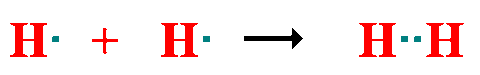
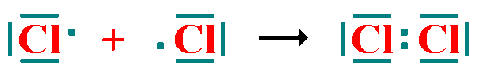
b) enlace covalente doble: Cada átomo aporta dos electrones al enlace, es decir, se comparten dos pares de electrones entre dos átomos. Un ejemplo es la molécula de Oxígeno (O2)
c) enlace covalente triple: Cada átomo aporta tres electrones al enlace, es decir, se comparten tres pares de electrones entre dos átomos, por ejemplo, la molécula de Nitrógeno (N2).
Es conveniente señalar que a medida que se compartan más pares de electrones, la distancia entre los átomos unidos será menor y el enlace será más fuerte (hará falta más energía para romperlo)
Atendiendo a cómo están compartidos los electrones:
Todos los ejemplos vistos hasta ahora son de este tipo.
b) enlace covalente polar: En un enlace covalente entre dos átomos iguales, los electrones del enlace se hallan igualmente compartidos, y el caso del enlace iónico constituye el otro extremo en el que los e‑ se transfieren totalmente.
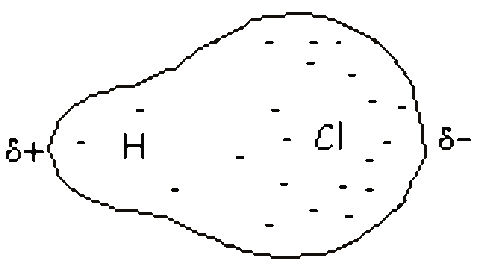
Al ser el átomo de cloro más electronegativo, atraerá más hacia él los electrones del enlace y se quedará cargado con una fracción de carga negativa.
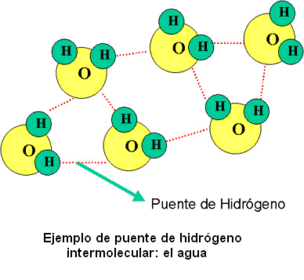
‑ el agua: la diferencia de electronegatividad entre el O y el H explica su elevada polaridad y ésto hace que pueda utilizar como disolvente.
‑ el amoniaco: la molécula de amoniaco posee tres enlaces simples polares.
c) enlace covalente coordinado o dativo: Es un enlace covalente en el que el par de e‑ que se comparte es aportado por un solo átomo. A los compuestos con este tipo de enlace se llaman complejos.
‑ el ion amonio; por ejemplo en el cloruro amónico (NH4Cl): es un compuesto iónico, forma redes tridimensionales, (NH4+ Cl‑), donde el catión no es un átomo sino una especie poliatómica en la que sus átomos están unidos por enlaces covalentes, uno de ellos coordinado o dativo:uno de los H ha perdido un e‑ y forma con el par de electrones que tiene el N, un enlace covalente coordinado.
‑ el ozono: En el enlace simple, es el átomo central el que aporta los dos electrones del enlace:aparecen dos estructuras para el Ozono que se denominan resonantes.
El fenómeno de resonancia surge ante la imposibilidad de poder representar el estado electrónico de una molécula o ion mediante una sola estructura. En estos casos, ninguna de las dos (o más) estructuras resonantes tienen existencia real, sino una hibridación de todas ellas. Por ejemplo, en el caso del ozono, los dos enlaces que forma el átomo central con los de los extremos, son exactamente iguales a pesar de que, en la estructura de Lewis, uno de ellos sea un enlace covalente doble y el otro un enlace covalente coordinado. Este fenómeno de la resonancia es bastante frecuente.

El enlace metálico se debe a la atracción entre los electrones de valencia de todos los átomos y los cationes que se forman.Este enlace se presenta en el oro, la plata, el aluminio, etc. Los electrones tienen cierta movilidad; por eso, los metales son buenos conductores de la electricidad. La nube de electrones actúa como "pegamento" entre los cationes. Por esta razón casi todos los metales son sólidos a temperatura ambiente.
Los átomos del metal pierden los electrones necesarios para tener estructura externa de gas noble y quedan cargados positivamente. Los electrones se quedan moviéndose entre los átomos positivos formando una “nube” de carga negativa que mantiene unidos a los átomos positivos. Esto da lugar a una red metálica.

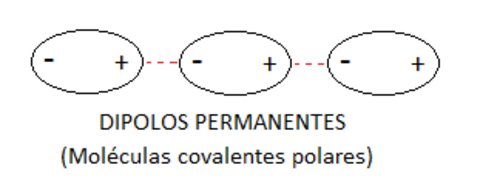
Denominamos dipolos a las moléculas que disponen de zonas cargadas negativamente y positivamente debido a la electronegatividad y concentración de los electrones en las moléculas.
Podemos asimilar el funcionamiento de un dipolo a un imán con su polo positivo y su polo negativo, de tal forma que si acercamos otro imán el polo positivo atraerá al polo negativo y viceversa, dando como resultado una unión.
Las fuerzas intermoleculares que actúan entre las moléculas se clasifican en :
Dipolos permanentes
Dipolos inducidos
Dipolos dispersos.
Puentes de hidrógeno

Dipolos dispersos
Este último caso la unión se produce entre moléculas no polares pero que pueden polarizarse, y cuando esto último ocurren se atraen mutuamente creando la unión molecular.
La unión que se crea en este tipo de dipolos tiene una intensidad muy débil y una vida muy corta
Las energías de unión generadas por las fuerzas intermoleculares son muy inferiores a las energías generadas en los enlaces químicos, pero a nivel global son superiores en número a estas últimas desempeñando un paple vital tanto en las propiedades de adhesión como de cohesión del adhesivo.

 Hide known cards
Hide known cards