estas son fichas para estudiar para el examen del segundo parcial
Pineado a
23
0
0
Sin etiquetas
|
|
Creado por Juan Galicia
hace alrededor de 5 años
|
|
Cerrar
|
|
Creado por Juan Galicia
hace alrededor de 5 años
|
|

La química inorgánica se encarga del estudio integrado de la formación, composición, estructura y reacciones químicas de los elementos y compuestos inorgánicos; es decir, los que no poseen enlaces carbono-hidrógeno, porque estos pertenecen al campo de la química orgánica.
la nomenclatura
el fin principal de la nomenclatura es proporcionar una metodología para identificarse sin ambigüedad
numero de oxidación
reglas
1.- para un elemento sin combinar el estado de oxidación es cero
2.-es un compuesto el elemento mas electronegativo lleva carga negativa y el menor carga positiva
3.- los metales alcalinos (1A) trabajan con más 1
4.- los metales alcalinotérreos (2A siempre trabajan con más 2
5.- el oxigeno siempre trabaja con menos dos excepto peróxidos menos 1
óxidos metálicos o básicos
M t O
trabajan nomenclatura
tradicional:óxido potásico
óxido nítrico
stock: óxido de potasio
óxido de nitrógeno II
sistemática: monóxido de dipotasio
dióxido de nitrógeno
oxoácidos
H2 t ion poliatómico
también tienen la tabla de los anhídridos
tradicional: ácido hiponitroso
balanceo por tanteo
Metales
no metales
Oxígenos
Hidrógenos

Posteriormente, Vamos con los hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo igualmente 6.
Entonces concluimos de la siguiente manera:
BALANCEO POR REDOX
1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
4. Los alcalinos tienen en sus compuestos oxidación +1
5. Los alcalinotérreos tienen en sus compuestos oxidación +2
6. Los alógenos tienen en sus compuestos con aluros oxidación -1
7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
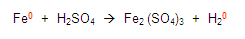
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
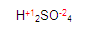
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
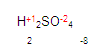
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
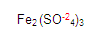
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).
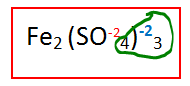
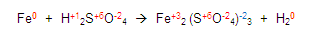

 Ocultar las fichas que te sabes
Ocultar las fichas que te sabes