Fichas sobre Actividad Integradora. Química, creado por Diego Aguilar Martínez el 24/11/2019.
Pineado a
87
0
0
Sin etiquetas
|
|
Creado por Diego Aguilar Martínez
hace más de 5 años
|
|
Cerrar
|
|
Creado por Diego Aguilar Martínez
hace más de 5 años
|
|

Enlaces Químicos
Enlace covalente.
No metálicos + No metal
Simple (A-A), doble (A=A) y triple (A≡A).
Según la presencia o no de polaridad, se puede distinguir entre enlaces covalentes polares (que forman moléculas polares) y enlaces covalentes no polares (que forman moléculas no polares).
Enlace iónico.
Metal + No metal
Produce una molécula cargada eléctricamente en algún sentido, ya sea cationes (+1) o aniones (-1).
Enlace metálico.
Metal + Metal
Junta los núcleos atómicos entre sí rodeados de sus electrones como en una nube.
Nomenclatura Química
Normas que determinan la manera de nombrar o llamar a los diversos materiales químicos.
Existen tres sistemas:
Sistema estequiométrico o sistemático (IUPAC). Que nombra los compuestos en base al número de átomos de cada elemento que forman su molécula básica.
Sistema funcional, clásico o tradicional. Que emplea diversos sufijos y prefijos (como “-oso” o “-ito”) según la valencia de los elementos del compuesto.
Sistema STOCK. El nombre del compuesto incluye en números romanos (y a veces como subíndice) la valencia de los átomos presentes en la molécula básica del compuesto.
Varía dependiendo de si se trata de compuestos orgánicos o inorgánicos.
Óxidos Metálicos, Anhídridos, Hidróxidos
Oxígeno (O) + Elemento Metálico (X) = Óxido básico o metálico.

Hidrácidos, Haluros
Un haluro es un compuesto binario en el cual una parte es un átomo halógeno y la otra es un elemento, catión o grupo funcional que es menos electronegativo que el halógeno. Según el átomo halógeno que forma el haluro este puede ser un fluoruro, cloruro, bromuro o yoduro, todos elementos del grupo XVII en estado de oxidación -1.
Hidrácido es un compuesto binario ácido en el que el hidrógeno está unido a un no metal del grupo 7A (halógeno) o, diferente del oxígeno, del grupo 6A (anfígeno) de la tabla periódica de los elementos. La facilidad de ionización de los ácidos binarios depende de dos factores: la facilidad con que se rompe el enlace entre el hidrógeno y el no metal, y la estabilidad de los iones resultantes en solución.
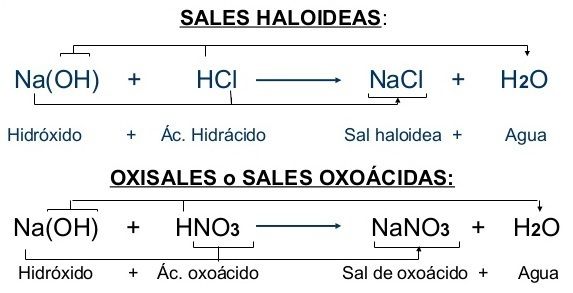
Sales Haloideas, Oxiácidas, Oxisales
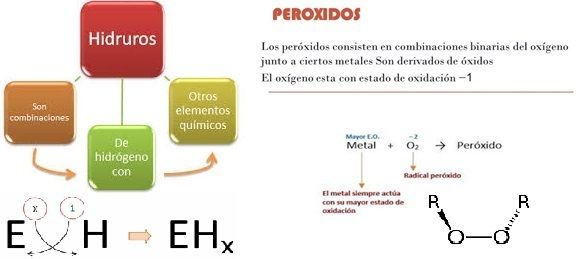
Peróxidos, Hidruros
Tipos de reacciones químicas
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos.

Balanceo de ecuaciones químicas
Consiste en que las dos ecuaciones tengan los átomos de cada elemento químico en igual cantidad, aunque estén en moléculas distintas (en diferentes sustancias).
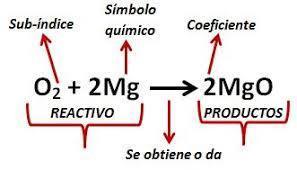
Balanceo de ecuaciones químicas por tanteo
El método de tanteo para balancear una ecuación química consiste en igualar el número y clase de átomos, iones o moléculas reactantes con los productos a fin de cumplir la Ley de la conservación de la materia.
Balanceo de ecuaciones químicas por Redox
El método del cambio del número de oxidación se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.

 Ocultar las fichas que te sabes
Ocultar las fichas que te sabes