Fichas sobre Fichas, creado por GAMALIEL CRUZ MARTINEZ el 24/02/2020.
Pineado a
6
0
0
Sin etiquetas
|
|
Creado por GAMALIEL CRUZ MARTINEZ
hace casi 5 años
|
|
Cerrar
|
|
Creado por GAMALIEL CRUZ MARTINEZ
hace casi 5 años
|
|

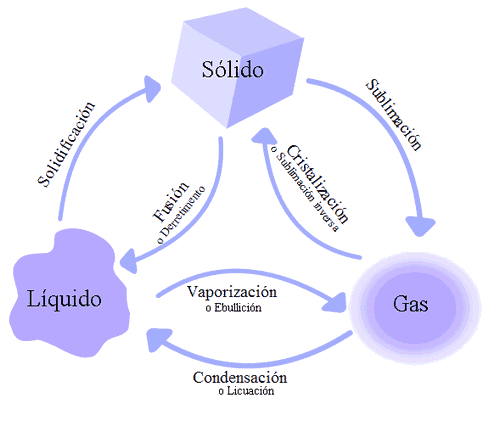
Cuando el agua llega a los 100ºC (en estado líquido) se evapora, pero aquellas moléculas que todavía están bajo los 100ºC, se mantienen en estado líquido.
El estado de un gas queda determinado al relacionar cuatro magnitudes: volumen (V), temperatura (T), presión (P) y cantidad de gas expresada en moles (n).
Ley de Charles:
Corresponde a las transformaciones que experimenta un gas cuando la presión es constante.
Ley de Gay-Lussac:
Corresponde a las trasformaciones que sufre un gas ideal cuando el volumen permanece constante.
Ley de Boyle:
Corresponde a las transformaciones que experimenta un gas cuando su temperatura permanece constante.
Ley de Avogadro
Consideremos ahora un proceso en el que cambie la presión el volumen y la temperatura.
Ley de Dalton:
Pi=xiP , donde Pi es la presión parcial del gas i, xi es la fracción molar del gas i en la mezcla de gases y P es la presión total.
Ley de Graham:
Las velocidades de difusión de dos gases son inversamente proporcionales a sus raíces cuadradas de sus densidades.

 Ocultar las fichas que te sabes
Ocultar las fichas que te sabes