Este trabajo nos indica los elementos de la nomenclatura.
Pineado a
18
0
0
|
|
Creado por Ana Lira
hace casi 8 años
|
|
Cerrar
|
|
Creado por Ana Lira
hace casi 8 años
|
|

ELEMENTOS DE LA NOMENCLATURA
Al conjunto de palabras y símbolos utilizados de manera sistemática y generalizada para nombrar y representar los diferentes compuestos químicos inorgánicos se le conoce como Nomenclatura Química Inorgánica.
COMPUESTOS ORGÁNICOS
Formados por un elemento central, tienen átomos de hidrógeno, oxigeno, y nitrógeno, en algunos casos se incorporan algunos metales.
El termino Nomenclatura Química Inorgánica se refiere al conjunto de símbolos y términos utilizados para nombrar y representar los compuestos químicos inorgánicos.
La formula empírica indica la mínima relación entre los elementos de las sustancias. La formula molecular indica el numero exacto de átomos de cada elemento que forma una sustancia, la formula empírica indica la relación mínima entre los átomos de cada elemento que forma una sustancia
VALENCIA Y NUMERO DE OXIDACIÓN
Es el numero de cargas que tendrá un átomo en una molécula (o en un compuesto ionico). El numero de oxidación va a indicar el numero de electrones transferidos de un átomo a otro átomo o el numero de electrones compartidos.
CLASIFICACIÓN DE LOS COMPUESTOS INORGÁNICOS
Se agrupan en conjuntos llamados Funciones Químicas, compuestos con propiedades físicas y químicas, se le conoce como grupo funcional. Las funciones mas importantes en química inorgánica son la función oxido, ácidos, sal e hidróxidos.
TIPOS DE COMPUESTOS INORGÁNICOS
Existen 3 sistemas de nomenclatura, los tres emplean dos palabras en su nomenclatura, la primera hace referencia a la función química, la segunda indica el tipo de compuesto.
ÓXIDOS
Formado por la unión de átomos de oxigeno y de metales, para nombrar a un oxido se deben seguir los siguientes pasos: Interactúa con numero de oxidación 2-, el metal interactúa con numero de oxidación positivo, en sus compuestos la suma algebraica debe ser cero, la formula molecular se indica el elemento con numero de oxidación positivo en este caso el metal, después el negativo. M+O2-->M-O
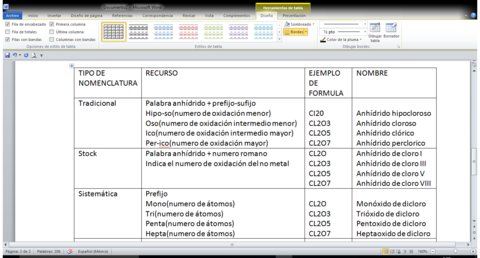
ANHÍDRIDOS
Conocidos también como óxidos no metálicos u óxidos ácidos, producto de la unión de un no metal y el oxigeno. Para escribir su formula molecular se siguen las mismas indicaciones que en los óxidos, en este caso los no metales trabajaran con sus respectivos números de oxidación positivos. NM+O2-->NM-O
Para nombrar los hidróxidos es el mismo procedimiento que para los óxidos, con la diferencia que se sustituye la palabra oxido por hidróxido.
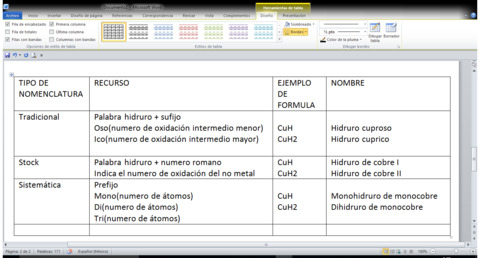
HIDRUROS METÁLICOS
La combinación de átomos de hidrógeno con un átomo metálico M + H1+ --> M-H.
Este es el único caso que el hidrógeno reacciona con un numero de oxidación 1-se debe a que acepta electrones de los átomos metálicos.
En este caso el hidrógeno trabaja con numero de oxidación 1+, debido a que comparte el par electrónico de enlace y el no metal trabaja con su numero de oxidación negativo H1+ +NM--> HNM En este caso las 3 nomenclaturas coinciden en la forma de nombrarlos primero la palabra ácido seguida del nombre del no metal con la terminación hidrico.
OXIÁCIDOS
Son compuestos terciarios de la unión del ion hidronio con un átomo no metálico y uno o mas átomos de oxigeno
H1+ +NMO --> HNMO. En este caso el numero de oxidación sera 2- y los no metales serán positivos. Para la nomenclatura sistemática se hace lo mismo que en la tradicional con la diferencia que se sustituye la palabra anhídrido por ácido.
SALES BINARIAS
Son la unión de un metal y un no metal, son compuestos binarios ionicos, están formados por un catión, el metal, un anión y un no metal M+ + NM- --> -NM
OXISALES
Son compuestos terciarios o ternarios, formados por un (cation) y un no metal unido al átomo de oxigeno
M+ + (NMO)- --> M-NMO, en este caso la nomenclatura tradicional y la sistemática del cation el metal llevara la terminacion oso del ácido, y del anión ito y la nomenclatura ico por ato.

 Ocultar las fichas que te sabes
Ocultar las fichas que te sabes