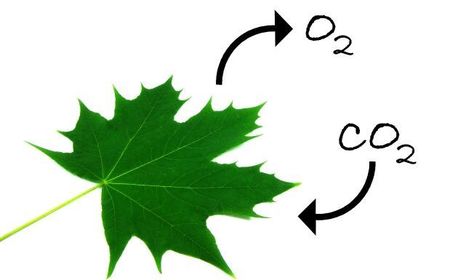
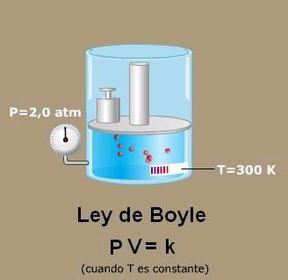
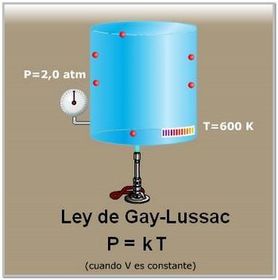
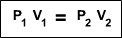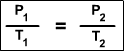En este archivo se habla de las propiedades de los gases e importancia de ellos en la cotidianidad, asi mismo las cosas buena y malas
Pin adicionado em
235
3
0
|
|
Criado por santiagotriana
quase 10 anos atrás
|
|
Fechar