Staatsexamen Biochemie FlashCards sobre Biochemie B1 Enzyme, criado por Mitra Shadloo em 02-01-2016.
Pin adicionado em
198
9
0
Sem etiquetas
|
|
Criado por Mitra Shadloo
mais de 8 anos atrás
|
|
Fechar
|
|
Criado por Mitra Shadloo
mais de 8 anos atrás
|
|

Die Reaktionsgeschwindigkeit
Nimmt z. B. die Konzentration eines Stoffes A in einer Sekunde um 2 mmol/l ab,
beträgt die Reaktionsgeschwindigkeit:
Die Reaktionsgeschwindigkeit hängt ab von
Warum wird Pro Zeiteinheit wird nur ein bestimmter Prozentsatz der Ausgangssubstanz(en) zum
Produkt umgesetzt?
Übergangszustand
Aktivierungsenergie
Darstellung des Übergangszustandes im Energiediagramm
Eine Reaktion läuft umso schneller ab, je...
Mitunter kann die Bildung eines Übergangszustandes durch die Wechselwirkung mit einem weiteren Stoff erleichtert werden.
Enzyme sind...
Enzyme erleichtern
katalytische (aktive) Zentren
Diese Bindung beruht auf
dem...
"Induced fit" bei der Bildung des
Enzym-Substrat-Komplexes
Die Katalyse der chemischen Reaktion
kommt dadurch zu Stande, dass...
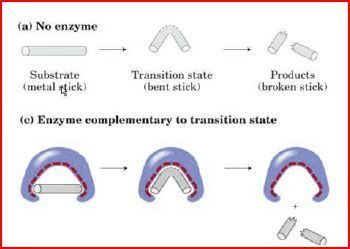
Die Stabilisierung des Übergangszustandes gilt für...
Enzyme sind...
Affinität ist...
Warum finden nur selten Nebenreaktionen statt?
Was sind Coenzyme?
Wo kommen sie vor?
Was sind Beispiele für Coenzyme?
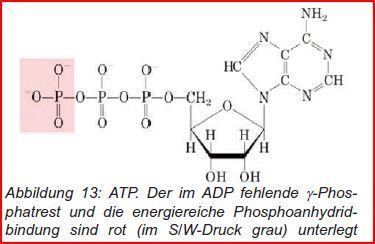
Im Körper sollen viele Reaktionen mit stark positivem dG ablaufen, bei denen im Gleichgewicht fast kein Produkt vorliegt:
Beispiel: Phosphorylierung von Glucose
Glucose+Pi <=> Glucose-6-Phosphat+H2O
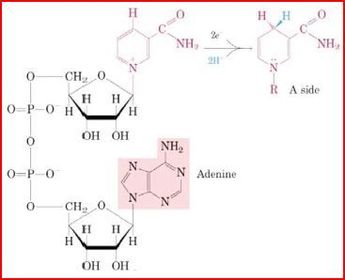
Eigenschaften & Funktion von NADH/H+
Isoenzyme
Diagnostik mit Isoenzymen
LDH
Kreatinkinase
Kreatinkinase
CK-Isoformen
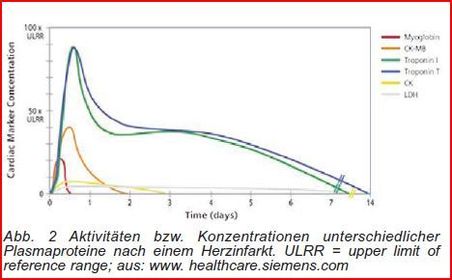
Regulierbarkeit der Enzyme
Schrittmacherenzyme & Endprodukthemmung
Endprodukthemmung:
Kompetitive Hemmung:
Was passiert mit vmax?
Was passiert mit Km?
Warum wird Km erhöht?
Methotrexat
Effekt des kompetitiven Inhibitors Methotrexat (MTX) auf die Dihydrofolat-
Reduktase (DHFR)
1) Darstellung im Michaelis-
Menten-Diagramm.
Darstellung im Lineweaver-
Burke-Diagramm.
Nicht-kompetitive
Allosterische Hemmung
Beispiel nicht-kompetitive Hemmung
Funktionsweise von Medikamenten als Enzyminhibitoren
Bsp.: Penicillin
Was passiert jetzt?
Arsen
Cyanid
Was macht es?
Was ist die Folge?
Warum Methämoglobin?
Allosterische Effekte
Kooperativität
Allosterische Effekte
Steigerung der maximalen Reaktionsgeschwindigkeit durch einen allosterischen Aktivator (allosterische Regulation vom V-Typ).
Erhöhung von vmax
Beeinflussung der Enzymaffinität durch allosterische Effektoren (allosterische Regulation vom K-Typ).
Änderung Km-Wert
Dagegen Myoglobin
O2-Bindungskurven von Hämoglobin und Myoglobin: Anders als bei Myoglobin wirkt O2 bei Hämoglobin als allosterischer Aktivator. Die Bindung von O2 an eine Hämoglobin-Untereinheit steigert die O2-Affinität der übrigen Untereinheiten
Regulation durch Phosphorylierung
Wie und wo geschiet das?
Was passiert dadurch?
Zymogenaktivierung
Wie wird aktiviert?
Wo findet was ähnliches statt?
Michaelis-Menten-Kinetik
Was passiert dann?
Reaktionsschema
Der geschwindigkeitsbestimmende Schritt unter diesen Voraussetzungen ist...
Daraus ergibt sich eine Formel für die Reaktionsgeschwindigkeit:
Wie lässt sich die Reaktionsgeschwindigkeit steigern?
Stellt man die Reaktionsgeschwindigkeit
in Abhängigkeit von der [Substrat] grafisch dar (Michaelis-Menten-Diagramm), ergibt sich eine Hyperbel, die der maximalen Geschwindigkeit vmax entgegenstrebt
Fazit
Manche Medikamente bewirken eine irreversible Inaktivierung bestimmter Enzyme. Beispiel ASS
Die Michaelis-Menten-Konstante Km
Michaelis-Menten-Diagramm zweier Enzyme gleicher Substratspezifität,
aber mit unterschiedlichem Km-Wert
Km1
Km2
Fazit
Wovon hängt die Affinität eines Enzyms zu seinen Substraten ab?
Es lässt sich zeigen, dass der Km-Wert...
Wie ändert sich der Km-Wert, wenn die Enzymkonzentration und mit ihr der vmax-
Wert reduziert wird, z. B. bei der Zyklooxygenase durch die Reaktion mit Acetylsalicylsäure?
Fazit
Die Michaelis-Menten-Gleichung
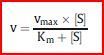
Stellt man sie etwas anders dar, kann man
sich einige Charakteristika enzymkatalysierter
Reaktionen ableiten:
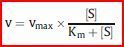
Substratsättigungsdiagramm
Lineweaver-Burk-
Diagramm
Lineweaver-Burk-
Diagramm
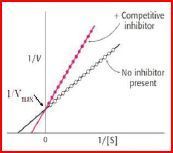
Lineweaver-Burk-Diagramm
Methanolvergiftung
Therapie
Koffein
Wirkung
Zweite Wirkung
Die Bestimmung der CK-Aktivität erfolgt durch ...
Warum nutzen wir drei Reaktionen?
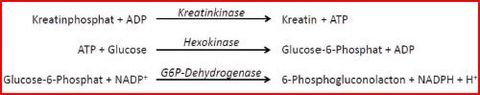
Warum NAD(P)+ / NAD(P)H/H+?
Berechnung der Volumenaktivität
katalytische Aktivität
Um die Volumenaktivität aus der Reaktionsgeschwindigkeit zu berechnen, müssen Sie mit Hilfe des Lambert-Beerschen-Gesetzes die Konzentration von NADPH aus dessen Extinktion berechnen:
Wechselzahl
Um die Wechselzahl zu bestimmen, ermittelt man...
Grundsätzlich sind zwei Wege zu unterscheiden, über die ein Signal in die Zelle gelangen kann:
1)
2)
Zur zweiten gruppe gehören alle...
Je nach dem Mechanismus, über
den die Weitergabe des Signals erfolgt,
unterscheidet man 4 verschiedene
Rezeptortypen:
G-Protein gekoppelte Rezeptoren
Wie wird die Signalübertragung vermittelt?
Die Konzentration folgender intrazellulärer Mediatoren wird über G-Proteingekoppelte Rezeptoren beeinflusst:
Mechanismus der Signaltransduktion
Aufbau des Rezeptors Aufbau des Rezeptors
Alle G-Protein-gekoppel
Schematische Darstellung der G-Protein-vermittelten Signaltransduktion
Aufbau der heterotrimeren G-Proteine
In der nicht stimulierten Zelle:
Reaktionszyklus der heterotrimeren G-Proteine
Aktivierung des G-Proteins:
Die Konformationsänderung der α-Untereinheit nach Bindung durch den Rezeptor hat zwei wichtige Konsequenzen
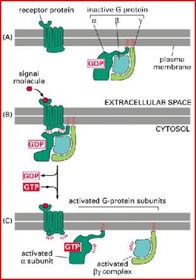
Inaktivierung des G-Proteins:
GTPase-aktivierender Proteine
(GAPs)
Die heterotrimeren G-Proteine werden nach der Familienzugehörigkeit der α-UE in vier Hauptklassen unterteilt:
Gs
Gi
Gq
Enzymgekoppelte Rezeptoren
Guanylatzyklasen
Es gibt zwei Klassen von Guanylatzyklasen, die sich in ihrer Struktur und ihrer
subzellulären Lokalisation, vor allem aber in ihrer Aktivierung durch Liganden unterscheiden:
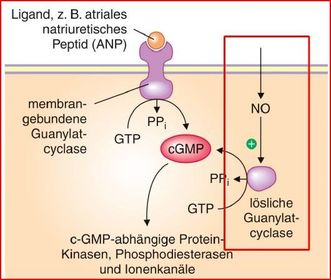
cGMP-vermittelte Wirkungen
Hauptfunktion von NO
Die Folgen sind:
NO führt über die Bildung von cGMP zur
Relaxation der glatten Muskulatur
NO - Synthase
Guanylatcyclase:
cGMP aktiviert die Proteinkinase G (PKG)
Signalweg NO & Gefäße Teil 1
Signalweg NO & Gefäße Teil 2
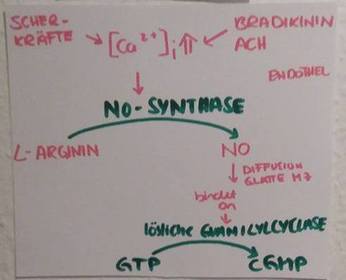
Wie wird cGMP inaktiviert?
Für welchen Vorgang ist NO noch wichtig?
Blutdruckregulation
Für welchen Vorgang ist NO noch wichtig?
Erektion
Folge:
Wie wirkt Viagra?
Sehvorgang
Nebenwirkungen Viagra

 Ocultar acertos
Ocultar acertos