FlashCards sobre fichas, criado por Ariadna Corona em 12-11-2016.
Pin adicionado em
5
0
0
Sem etiquetas
|
|
Criado por Ariadna Corona
aproximadamente 8 anos atrás
|
|
Fechar
|
|
Criado por Ariadna Corona
aproximadamente 8 anos atrás
|
|

NOMECLATURA INORGANICA

La fórmula molecular expresa el número real de átomos que forman una molécula a diferencia de la fórmula química que es la representación convencional de los elementos que forman una molécula o compuesto químico. Una fórmula molecular se compone de símbolos y subíndices numéricos; los símbolos corresponden a los elementos que forman el compuesto químico representado y los subíndices son la cantidad de átomos presentes de cada elemento en el compuesto. La fórmula molecular se utiliza para la representación de los compuestos inorgánicos y en las ecuaciones químicas. También es útil en el cálculo de los pesos moleculares.
ESTADOS DE OXIDACION
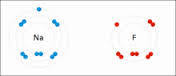
-Todos los elementos metálicos (los cuales ceden electrones) cuando forman compuestos tienen generalmente estados de oxidación positivos.
-Los elementos no metálicos y semimetálicos pueden tener estados de oxidación positivos y negativos, dependiendo del compuesto que estén constituyendo.
-Para cualquier elemento el máximo estados de oxidación es el correspondiente al número de grupo.
-El mínimo estado de oxidación posible de un elemento es 4−, y lo tienen algunos de los elementos del grupo 4A.
-Los no metales tienen un estado de oxidación negativo único, que es igual al número de grupo menos 8.
-Los elementos de los grupos 1A y 2A poseen los estados de oxidación 1+ y 2+ respectivamente
-El hidrógeno funciona con estado de oxidación 1+ generalmente, a excepción cuando forma hidruros metálicos en donde su estado de oxidación es 1−.
-El número de oxidación del O es 2−, excepto cuando forma peróxidos, donde es 1−, y cuando forma superóxidos, donde es 1/2−.
-La suma de los estados de oxidación de los elementos de un compuesto es igual a su carga neta.
OXIDOS
El Oxido es un compuesto inorgánico que se forma al unir algún elemento químico con Oxígeno. Los óxidos se clasifican en dos grupos: Óxidos Básicos y Óxidos Ácidos.
Los óxidos son compuestos binarios formados por la combinación del oxígeno con un elemento químico.
El oxígeno actúa con su número de oxidación (-2), mientras el otro elemento actúa con un número de oxidación positivo.
Un Óxido es básico si el elemento químico que se junta con el Oxígeno (O) es un metal.
Un Óxido es Ácido si el elemento químico que se junta con el oxígeno es un no metal.
ACIDOS
Son sustancias que libera iones hidrógeno (H+) cuando se disuelve en agua: Las fórmulas de los ácidos contienen uno o mas átomos de hidrógeno.
Son ácidos binarios formados por la combinación del hidrógeno con un elemento no metal.
Son ácidos ternarios que resultan de la combinación de un óxido ácido con el agua; por tanto, son combinaciones de hidrógeno, oxígeno y un no metal. Se pueden considerar a efectos de formulación como el resultado de la adición de una molécula de agua a la de un anhídrido; por lo tanto, la valencia con la que actúa el no metal es la positiva. Estos compuestos se nombran con la palabra ácido, seguida del nombre del anhídrido, del que se considera derivado.
SALES
Una sal es un compuesto químico formado por cationes enlazados a anionesmediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión, y el ácido el anión.Según la nomenclatura tradicional, las sales se denominan con el nombre del anión, con cierto prefijo y sufijo, seguido de la preposición de y el nombre del catión. Hay que distinguir entre distintos casos:
En las sales de hidrácidos, se sustituye la terminación -hídrico del hidrácido del que proviene el anión para la terminación -uro. Por ejemplo, NaCl es el cloruro de sodio; el anión Cl- proviene del hidrácido HCl
En las sales de oxoácidos, se sustituye la terminación -oso o-ico del oxoácido del cual proviene el anión por la correspondiente - ito o -ato. Por ejemplo, el Ca3(PO4)2 es el fosfato de calcio; el anión PO43- proviene del H3PO4 Las sales ácidas se denomina indicando el número de hidrógenos no sustituidos que quedan en la molécula, usando el prefijo correspondiente.
SISTEMAS DE NOMECLATURA
STOCK
Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”.
La valencia (o número de oxidación) es el que indica el número de electrones que un átomo pone en juego en un enlace químico, un número positivo cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar electrones.
De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera:
*nombre genérico + de + nombre del elemento específico + el No. de valencia.
Ejemplo: Fe2S3, sulfuro de hierro
TRADICIONAL
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son: Cuando el elemento sólo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” y en algunos casos se puede optar a usar el sufijo –ico.
Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
-oso cuando el elemento usa la valencia menor: Fe+2O-2, hierro con la valencia +2, óxido ferroso
-ico cuando el elemento usa la valencia mayor: Fe2+3O3-2, hierro con valencia +3, óxido férrico2
Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
oso (para la valencia intermedia)
-ico (para la mayor valencia)
Cuando entre las valencias se encuentra el 7 se usan los prefijos y sufijos.
hipo- … -oso (para las valencias 1 y 2)
-oso (para la valencias 3 y 4)
-ico (para la valencias 5 y 6)
per- … -ico (para la valencia 7):
Ejemplo: Mn2+7O7-2, óxido permangánico (ya que tiene más de tres números de valencia y en este compuesto está trabajando con la valencia 7)

 Ocultar acertos
Ocultar acertos